תוכן עניינים
- מהי אורטיקריה
- הסימפטומים של האורטיקריה - כיצד לזהות את המחלה
- מה גורם לאורטיקריה
- איך מאבחנים אורטיקריה
- כמה זמן נמשכת האורטיקריה
- הטיפול באורטיקריה
- 8 דרכים להקל על אורטיקריה
- אורטיקריה בקרב ילדים ותינוקות
- סיבוכים של אורטיקריה
- מחלות הקשורות לאורטיקריה
- אורטיקריה וסרטן
- טיפול טבעי באורטיקריה
- הומאופתיה לטיפול באורטיקריה
- אורטיקריה רפואה סינית
- אורטיקריה באיורוודה
- נטורופתיה לטיפול באורטיקריה
- אורטיקריה תרופות סבתא
- אורטיקריה ביטוח לאומי
- אורטיקריה קהילות ותמיכה
- שאלות ותשובות נפוצות
אורטיקריה – כל מה שרציתם לדעת ולא העזתם לשאול
אורטיקריה – מידע מקיף ועדכני אודות המחלה האוטואימונית עתיקת הימים. מפתרונות ברפואה המערבית ועד לרפואה הסינית + מקורות לתמיכה מחוויות דומות.
קצר בזמן? הנה סיכום מקוצר:
אורטיקריה היא תפרחת עור מגרדת, לרוב בצבע אדום, אשר לעיתים גם עוקצת ו'שורפת' (ממש כמו סרפד). זו מחלה מאוד נפוצה: אדם אחד מכל חמישה יחלה בה, ואחד מכל 20 אנשים יסבול מאורטיקריה כרונית (3).
לרוב פורצת המחלה בעקבות תגובה אלרגית לתרופה, למזון או לגירוי מהסביבה. במרבית המקרים הללו אין סכנה בריאותית לחולה, והאורטיקריה תחלוף מעצמה כאשר תיפסק החשיפה לגורם האלרגיה. למרות הגורם למחלה, חשוב לא להתבלבל: האורטיקריה אינה מחלה אלרגית, אלא אימונולוגית – כלומר מערכת החיסון תוקפת את עצמה.
כשמדברים על אורטיקריה חשוב להבחין בין אורטיקריה חריפה – שהיא תגובה אלרגית לחרקים, למזון, לתרופות וכיו"ב – לבין אורטיקריה כרונית, הנמשכת מעל שישה שבועות. שתיהן, חשוב לציין, לרוב אינן מסכנות חיים.
אורטיקריה חריפה:
סוג זה של אורטיקריה הוא הנפוץ ביותר, וגם ההחלמה ממנו מהירה יותר: לרוב האורטיקריה תחלוף לאחר מספר ימים, כאשר תיפסק החשיפה לגורם האלרגיה. למעט מקרים נדירים, האורטיקריה אינה מסכנת חיים, ולרוב היא תחלוף מאליה גם ללא טיפול רפואי. עם זאת, שימוש בכדורים מסוג היסטמינים עשוי בהחלט לזרז את ההחלמה ולהקל על הגירוד ועל שאר התסמינים.
אורטיקריה כרונית:
במרבית המקרים שבהם מתפרצת אורטיקריה כרונית, אי אפשר לזהות מה גרם להתפרצות המחלה. בנוסף, אורטיקריה כרונית יכולה להימשך חודשים ואף שנים – אם כי היא עשויה לחלוף גם מהר יותר. השימוש בתרופות מסוג אנטי-היסטמינים הוא עיקר הטיפול הקונבנציונלי – הרעיון הוא לסמן לגוף שאין לו סיבה להילחם. בין אם הטיפול נעשה באמצעות תרופות ובין אם במישור הפסיכולוגי, חשוב לא להילחץ נוכח התופעה המלחיצה ולנסות להירגע ככל האפשר.
אם מעולם לא שמעתם את המילה הזו ולא חליתם באורטיקריה, או בשמה העברי: סרפדת (או חרלת), אתם יכולים להחשיב את עצמכם בני מזל – שכן הסטטיסטיקה אינה קלה: אחד מכל חמישה אנשים יחלו באורטיקריה במהלך חייהם, וכ-10% מהילדים יחלו באורטיקריה לפחות פעם אחת (1). כמו כן, 5% מהאנשים יחלו באורטיקריה כרונית שיכולה להימשך אף למעלה משישה שבועות (3).
למען האמת, אורטיקריה אינה מחלה חדשה. כבר לפני 5,000 שנה הוזכרה המחלה בספר הקיסר הצהוב (2), אך בשם אחר – Feng Yin Zheng. רק בשנת 1769 ניתנה למחלה השם המוכר לנו כיום, אורטיקריה – על שם המילה הלטינית אורטיקה (סרפד).
ההתמודדות עם מחלת האורטיקריה עלולה להיות כלל וכלל לא פשוטה, הן מבחינה פיזית והן מבחינה פסיכולוגית, ובמיוחד בקרב אלו הסובלים ממנה שבועות ולעיתים אף שנים. ומה שמתסכל במיוחד הוא שהמחלה עשויה להופיע אצל כל אחד – ללא תלות בגילו או במצבו הבריאותי.
ריכזנו עבורכם כל מה שצריך וכדאי לדעת על בעיה נפוצה זו – כולל מדוע היא מופיעה (ככל שהמדע יודע לענות על כך), מתי לפנות לרופא, דרכים קונבנציונליות וטבעיות לטיפול באורטיקריה, התמודדות עם המחלה ועוד.
מהי אורטיקריה
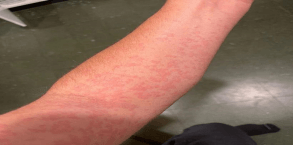
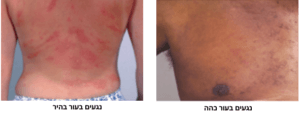
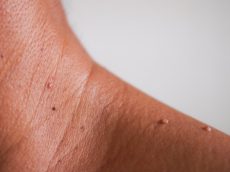
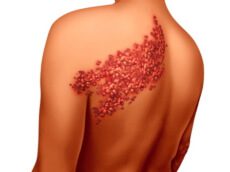
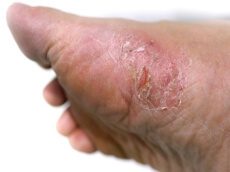
אורטיקריה, או בשמה העברי: סרפדת (או חרלת), היא תפרחת אדומה ומגרדת מאוד על העור. התפרחת יכולה להופיע בכל חלק של הגוף, בגדלים שונים – ושטחה עשוי להשתנות ממקרה למקרה ומאיבר לאיבר. לעיתים גם ניתן לראות כמה אזורים קטנים שהתחברו ביניהם לתפרחת ענקית.
תפרחת המופיעה על העור נעלמת לרוב לאחר 24 שעות או פחות, ובמקומה עשויות להופיע תפרחות חדשות. התקף אורטיקריה שכזה נמשך שישה שבועות לכל היותר (סוג זה של אורטיקריה נקרא אורטיקריה חריפה – acute hives), ואם התפרחת נמשכת מעל שישה שבועות, מדובר באורטיקריה כרונית.
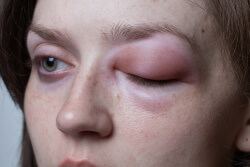
כאמור, המונח הרפואי לתפרחת זו הוא אורטיקריה. מונח רפואי נוסף שכדאי להכיר הוא אנגיואדמה – מצב שבו נוצרים פצעים גדולים עמוק מתחת לעור. אנגיואדמה יכולה להתפרץ בשילוב עם אורטיקריה ולגרום להתנפחות העפעפיים והעיניים, כפי שניתן לראות בתמונה – ובמקרה כזה יש לפנות לטיפול רפואי (4)
פופולריים:
הסימפטומים של האורטיקריה - כיצד לזהות את המחלה
הסימפטומים של מחלת האורטיקריה דומים מאוד לאלו המופיעים לאחר נגיעה בסרפד (ומכאן השם סרפדת). מדובר בנגעים אדומים, בגדלים שונים, היוצרים תחושת גירוד בעור. לאחר הופעת הסימפטומים הם עשויים להימשך דקות ספורות, חודשים, או אפילו שנים.
הנגעים יכולים להופיע בכל אזור בגוף, לשנות צורה, להיעלם – ואז להופיע שוב לאורך פרקי זמן קצרים. יש כאמור שני סוגים עיקרים של אורטיקריה, כרונית וחריפה – בואו נכיר את הסימפטומים של המחלה:
- נגעים אדומים שעשויים להופיע בכל מקום בגוף
- נגעים בעור המשנים את גודלם, נעלמים ומופיעים שוב תוך זמן קצר
- גירוד – שעלול גם להתפתח לכדי גירוד קשה מאוד
- אנגיואדמה – נפיחות בשפתיים ובעפעפיים
- הופעה מוגברת של הנגעים לאחר אימון גופני, לחץ, או חשיפה לקור או חום
- בעת לחיצה על העור הנגעים נעלמים – ומופיעים שוב כשמפסיקים ללחוץ
- אורטיקריה חריפה – הנגעים נעלמים מהר, לרוב בטווח של ימים, עד שישה שבועות
- אורטיקריה כרונית – קיומם של הנגעים במשך תקופה העולה על שישה שבועות
מה גורם לאורטיקריה
אמנם לאורטיקריה יכולות להיות סיבות רבות, אך לכולן מכנה משותף אחד: כולן נוצרות כאשר מופעלים בגוף תאי חיסון הנקראים 'תאי תורן'. פעמים רבות משחררים תאי התורן הללו כימיקלים, וביניהם גם כימיקל הנקרא 'היסטמין' – והוא שעלול לגרום לנפיחות, לגירוד ולאדמומיות (5). ההיסטמין גורם להתרחבות כלי הדם, הוא משפיע על העצב – ולמעשה בכך הוא גורם לאדמומיות ולגירוד. יש לציין כי לא כל סוגי האורטיקריה נגרמים משחרור היסטמין, ייתכן כי כימיקלים אחרים יגרמו להתפרצות המחלה – אך ברוב המוחלט של המקרים ההיסטמין הוא האחראי העיקרי.
מי יכול לחלות באורטיקריה?
אורטיקריה, כאמור, היא מחלה מאוד נפוצה. כל אחד יכול לקבל אותה, ואין זה משנה מה גילו ומה מצבו הבריאותי.
מה גורם לתאי התורן להגיב ומדוע?
למען האמת, המומחים יודעים הרבה יותר טוב מה קורה בגוף האדם בזמן האורטיקריה מאשר מה גורם להתפרצותה. גם בהיבט הזה יש הבדל בין אורטיקריה חריפה לכרונית: באורטיקריה חריפה התשובה, בדרך כלל, די פשוטה. לאחר תחקיר רפואי של החולה, לעיתים בתוספת בדיקות אלרגיה, בכ-50% מהמקרים ידע הרופא לזהות את גורם האלרגיה. למעשה כל תגובה אלרגית עלולה לגרום לאורטיקריה, אך אלו הגורמים הנפוצים ביותר:
- מזונות – פירות (במיוחד פירות הדר), חלב, ביצים, בוטנים, אגוזי עץ ודגים
- תרופות
- עקיצות חרקים
- בעלי חיים
- אבקות שונות
- מגע עם חומר שהאדם אלרגי אליו (כגון לטקס)
- זריקות אלרגיה
אורטיקריה כרונית, לעומת זאת, היא שונה: אף על פי ש-50% מהחולים יחלימו לחלוטין בטווח של עד שנה מרגע הכניסה למצב הכרוני, יש חולים שיחיו עם האורטיקריה כל חייהם. באורטיקריה כרונית נדירים מאוד המקרים שבהם הרופאים יצליחו לזהות מה הגורם למחלה, וככל שהחולה סובל ממנה זמן רב יותר, כך הסיכויים להחלמה יהיו נמוכים יותר.
להתפרצות אורטיקריה כרונית עשויות להיות סיבות רבות, אשר ניתן לחלקן לשני סוגים: תגובות אלרגיות ותגובות לא אלרגיות. האלרגנים אשר מעוררים את הנגעים בעור זהים לאלו הגורמים לאורטיקריה חריפה, כפי שצוין למעלה, ואילו הסיבות הלא-אלרגיות מורכבות ממגוון גורמים, כגון:
- חיידקים ויראליים
- אימוני כושר
- לחץ על העור
- חומר כימי
- חשיפה לשמש
- חום או קור
- מחלות אוטו-אימוניות – דוגמת זאבת או מחלות בבלוטות התריס
יש אפוא סיבות רבות להתפרצות האורטיקריה הכרונית, אך הנפוצות ביותר הן אוכל, תרופות וחרקים.
האם מתח גורם לאורטיקריה?
הדעה הרווחת ברפואה המערבית היא שמתח לבדו אינו מהווה גורם עצמאי למחלה, אך הוא בהחלט עלול להוביל להחמרה, הן באורטיקריה חריפה והן באורטיקריה כרונית. זהו 'מעגל קסמים' בעייתי: התפרצות המחלה יוצרת פעמים רבות מתח אצל החולה. המתח עלול להחמיר את האורטיקריה, מה שיגרום למתח נוסף. כמו כן, מתח עשוי לגרום לנדודי שינה, לדיכאון ולבעיות נוספות רבות. מסיבה זו חשוב 'לנהל' את המתח ככל האפשר, כדי לנסות לצמצם את תופעות המחלה ולהקל על החיים לצד המחלה ולאחריה.
איך מאבחנים אורטיקריה
ברובם המוחלט של המקרים, רופא עור – או אף רופא המשפחה – יוכל לאבחן אורטיקריה חריפה או כרונית בהסתכלות על העור בלבד. עם זאת, אבחון הגורם לאורטיקריה עשוי להיות אתגר מסובך מאוד, בעיקר אם המטופל חולה באורטיקריה מעל שישה שבועות.
כדי לברר מה גורם לאורטיקריה, רופא העור יבחן שלושה דברים:
- היסטוריית הבריאות של המטופל
- פעולות שנעשו על ידי המטופל טרם הופעת הנגעים, או דברים שהוא נחשף אליהם
- בדיקה פיזית של גוף המטופל
כמו כן, לעיתים יבקש הרופא את ביצוען של כמה בדיקות:
- בדיקות אלרגיה
- בדיקות דם – כדי לשלול זיהומים ומחלות אחרות
- ביופסיה – תהליך שבו מוסרת פיסה קטנה של עור נגוע ונבדקת במיקרוסקופ
כמה זמן נמשכת האורטיקריה
רוב הנגעים נעלמים תוך 24 שעות מרגע הופעתם, אך הם חוזרים בחלקים שונים של הגוף בצורה רנדומלית לגמרי. כאמור, אורטיקריה חריפה תחלוף תוך שישה שבועות לכל היותר, אורטיקריה כרונית תימשך מעל שישה שבועות – אך אין זה אומר שלאורך כל התקופה יסבול המטופל מנגעים מגרדים. הנגעים יכולים להופיע ולהיעלם לאורך כל התקופה.
הצד החיובי של המחלה הוא שהנגעים אינם משאירים סימנים לאחר היעלמותם, ללא קשר אם בוצע טיפול מסוים או לא. יתרה מזאת, למעט מקרים נדירים – האורטיקריה אינה מסכנת חיים. במרבית המקרים המחלה תחלוף לבד, גם ללא טיפול רפואי, אך שימוש הכדורים מסוג היסטמינים עשוי לזרז את ההחלמה ולהקל על הגירוד ועל שאר התסמינים.
הטיפול באורטיקריה
הטיפול הראשוני והפשוט ביותר במחלת האורטיקריה – במקרים שבהם ניתן לאתר ולזהות את גורם האלרגיה – הוא להתרחק מגורם האלרגיה ולהפסיק לצרוך אותו. במקרים שבהם לא ניתן לזהות את הגורם, הטיפול יהיה לרוב בכדורי אנטי-היסטמין. כדורים אלו עלולים לגרום לתופעות לוואי, אך כולם נוגדי היסטמין (שעשוי לעיתים לגרום לנפיחות, גירוד ואדמומיות (5)).
גם עבור אורטיקריה כרונית, קרי אורטיקריה הנמשכת יותר משישה שבועות, ישתמשו בדרך כלל בכדורי אנטי-היסטמין – וייתכן כי המטופל יצרוך יותר מכדור אחד ביום (כמובן, לאחר התייעצות עם רופא).
חשוב לציין כי יש כיום סוגים רבים של כדורים. הכדורים ה'וותיקים' יותר, מהדור הישן, ידועים כגורמים לעייפות בקרב הנוטלים אותם, ואילו חלק מהכדורים, בעיקר מהדור החדש, אינם גורמים כלל לתופעות לוואי.
האורטיקריה הכרונית תחלוף בדרך כלל בטווח של עד שנה, אך ידוע גם על אנשים הסובלים מאורטיקריה שנים רבות – שבמהלכן סימני המחלה מופיעים, נעלמים וחוזרים מעת לעת. עבור הטיפול באורטיקריה כרונית אישר ה-FDA שני סוגי תרופות (6):
- אנטי-היסטמין – חומר הנוגד את תהליך שחרור ההיסטמינים לגוף
- אומליזומאב – נוגדן IgE. זוהי תרופה המשמשת חולי אסתמה, אשר מחקרים העלו לגביה כי היא מציגה תוצאות טובות בלא מעט מקרים של טיפול באורטיקריה (כמובן, יש להיוועץ עם הרופא לפני תחילת השימוש) (7).
8 דרכים להקל על אורטיקריה
- כו לראות רופא מומחה. אמנם רופא המשפחה אמור להכיר את המחלה, וברוב המקרים הטיפול יכול להסתיים אצלו, אך עדיין מומלץ ללכת לרופא מומחה המכיר את המחלה לעומקה.
- התרחקו מגורמים הידועים כגורמי אלרגיה. יתרה מזאת – מומלץ לבצע בדיקת אלרגיה כדי לגלות למה אתם אלרגיים (אם בכלל).
- בזמן התקף של נגעים מרובים צלמו תמונות, כדי שבביקורכם אצל הרופא המתמחה באלרגיה תוכלו להראות לו את הנגעים, גם אם באותו הרגע לא יהיו לכם נגעים על העור.
- השתמשו באחת הדרכים הבאות (או בכמה מהן) כדי להרגיע עור מגרד:
- העבירו קוביית קרח על העור – הקרח מרגיע את הגירוד
- לבשו בגדים רחבים שאינם לוחצים על העור
- השתמשו במשחות עור להרגעה – יש הרבה מאוד משחות טבעיות אנטי-היסטמניות, דוגמת פניסטיל
- הימנעו מהגעה למצב של עור יבש – הקפידו למרוח משחות לחות
- עמדו מדי פעם מול מאוורר – זה יכול להרגיע את הגירוד
- שלבו ויטמין D בטיפול שלכם. על פי מחקר שנערך בינואר 2014, ויטמין D יכול לעזור בהפחתת התסמינים של האורטיקריה הכרונית.
- טיפול בכדורי אנטי-היסטמין, לעיתים במינון של עד 4-3 כדורים ביום (את המינון יש לקבוע אך ורק בהתייעצות עם רופא), בדרך כלל יעזור מאוד וירגיע את ההתפרצות.
- נסו להירגע ולהוריד את רמת המתח הנפשי. כאמור, המחלה יוצרת 'מעגל קסמים' בעייתי: המחלה גורמת למצוקה, המתח מעודד את המחלה, המחלה גורמת לעוד מתח וחוזר חלילה. נסו להירגע בדרכים שונות – מדיטציה, יוגה, או כל דרך אחרת.
- המשיכו להזכיר לעצמכם: האורטיקריה תחלוף. כשם שהיא הגיעה, כך היא תחלוף ולא תישאר איתכם לעד.
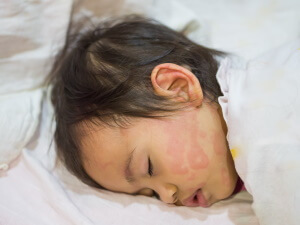
אורטיקריה בקרב ילדים ותינוקות
כמו בקרב בוגרים, גם בקרב ילדים ותינוקות המחלה מאוד נפוצה: ילדים רבים (ואולי אף מרבית הילדים) יחלו באורטיקריה לפחות פעם אחת בחייהם. גם הגורמים למחלה והתסמינים שלה זהים לאלו שחווים המבוגרים.
כשמדובר באורטיקריה בקרב ילדים ותינוקות, יש כמה נקודות שחשוב לדעת:
- כמו אצל מבוגרים, גם בגופם של הילדים יופיעו נגעים אדומים ומגרדים על כל חלקי העור
- הגורמים לאורטיקריה בקרב ילדים הם אוכל, תרופות, וכן טריגרים נוספים (מה עוד גורם לאורטיקריה? לחצו =>> מה גורם לאורטיקריה)
- הטיפול התרופתי כולל תרופות אנטי-היסטמניות שונות
- שמירת מרחק מהטריגר היא חלק מהותי וחשוב בטיפול
סיבוכים של אורטיקריה
הסיבוך הנפוץ ביותר, אשר ניתן לראותו בשיעור של 1 מכל 20 מקרים, הוא אורטיקריה כרונית. זהו מצב, כאמור, שבו המחלה נמשכת מעל שישה שבועות.
סיבוכים אחרים, אך מאוד נדירים:
- אנגיואדמה
- אנפילקסיס
- חרדה
- דיכאון
מחלות הקשורות לאורטיקריה
לעיתים האורטיקריה היא רק סימפטום של מחלה אחרת. לעיתים אף קורה שמתקבל אבחון מוטעה, כלומר מדובר במחלה אחרת שאובחנה בטעות כאורטיקריה. הנה כמה דוגמאות:
אלרגיה: אורטיקריה חריפה עשויה להיות תגובה אלרגית של הגוף לאחר חשיפה לאוכל, לבעל חיים, לבדים, לתרופות ועוד. הנגעים בעור יכולים להופיע מייד עם החשיפה, או לאחר כמה שעות (10).
עור מגורה: במקרים קלים מאוד של אורטיקריה קל להתבלבל בין המחלה לבין גירוי 'רגיל' של העור. הדרך לדעת אם מדובר בסתם גירוי או באורטיקריה היא לעקוב ולגלות אם הנגעים נעלמים וחוזרים.
פסוריאזיס: זוהי מחלת עור מאוד נפוצה, שבה נגעים אדומים מופיעים על העור. נגעים אלו יכולים לבלבל ולהיראות כמו תסמיני האורטיקריה. אחת הדרכים להבדיל בין שתי המחלות היא לחפש את קיומו של גוון לבן-כסוף, המאפיין רק את הפסוריאזיס ולא את האורטיקריה. לחצו כאן למאמר המלא על פסוריאזיס
אקזמה: זוהי מחלת עור שעשויה לעיתים להיראות כמו אורטיקריה. ההבדל העיקרי ביניהן הוא שבניגוד לאורטיקריה, שיכולה להופיע בכל חלקי הגוף, האקזמה מופיעה לרוב בפנים, בברכיים ובמרפקים בלבד.
רוזציאה: זוהי מחלה המופיעה בעיקר על הפנים ונראית לרוב כמו אקנה. פעמים רבות הנגעים ברוזציאה יהיו מלווים במוגלה. (11)
סוכרת מסוג 1: אורטיקריה כרונית הנמשכת זמן רב עשויה להיות אינדיקטור מוקדם לקיומה של סוכרת מסוג 1 (12).
אורטיקריה וסרטן
מדובר בתופעה מאוד נדירה, אך היו גם מקרים ספורים שקשרו סרטן באורטיקריה כרונית. כמו כן, יש מחקרים הטוענים כי אורטיקריה כרונית מתמשכת עלולה להגביר את הסיכון לחלות בסוגי סרטן שונים (13).
טיפול טבעי באורטיקריה
יש מגוון טיפולים טבעיים באורטיקריה (כאשר עקב הידע הלא מספיק של הרפואה הקונבציונלית המון אנשים מחליטים לפנות לרפואה הטבעית)
העיקרון המנחה של רובם הוא כזה:
"אלרגיה היא בעצם תגובה מוגזמת של הגוף לחוסר איום ממשי. לכן יש לחזק את מערכת החיסון כדאי שהיא לא תגיב בעוצמה כזאת לכל איום קטן."
יש דימוי נחמד לכלב:
"כלבים קטנים וחלשים נובחים בעוצמה על כל דבר
לאומת זאת כלב גדול וחזק לא מרגיש צורך לנבוך על כל דבר כי הוא בטוח בעצמו ובגודל שלו"
בנוסף נעשית עבודה פסיכולוגית\נפשית למצוא את חוסר האיזון הקיים באדם.
עיקרי הטיפולים הטיבעים באורטיקריה יהיה אחד מאלה:
- טיפול הומאופתי באורטיקריה
- דיקור ורפואה סינית
- צמחי מרפא לאורטיקריה בעלי פעילות אנטיהיסטמינית ונוגדת גרד
- המלצות לתזונה טיבעית מותאמת – תזונה ללא מטוגן, חריף, מוצרי חלב קפאין, חומרים משמרים.
- משחות טבעיות להקלה על הגירוד
- תוספי תזונה שונים
- שמנים אתריים לטיפול באלרגיה
צמחי מרפא בעלי פעילות אנטיהיסטמינית ונוגדת גרד, תוסף פרוביוטיקה ושינוי תזונה (ללא מטוגן, חריף, מוצרי חלב פרה, קפאין, דגים ומאכלי ים, חומרים משמרים).
הומאופתיה לטיפול באורטיקריה
בטיפול הומאופתי מתייחסים לגוף ולנפש כאחד. בטיפול ההומאופתי מאמינים שכל אדם הוא אינדיבידואל ולכן כל טיפול יתחיל משיחה ארוכה לתחקור והכרת האדם. לאחר מכן ימליצו על מה שנקראה רמדי – תכשיר הומאופתי – תמצית העשויה מצמחים ומינרליים.
הומאופתיה טוענים שניתן לטפל באדם בכך שנותנים לו תמצית שגורמת לאותם תסמינים שיש לו אבל בצורה מאוד מוחלשת.
הטיפול ההומאופתי נפוץ מאוד היום בעולם ורק בארה"ב ישנם מעל 5 מליון מטופלים בשיטה (14)
אנשים רבים מאוד ברחבי העולם טוענים שהצליחו להירפא לחלוטין מאורטיקריה באמצעות טיפול הומואפתי – חשוב לציין שלא מצאתי מחקר אקדמאי מספק בעניין לתוצאות חד משמעיות
למרות שהטיפול ההומאופתי הוא אינדיבידואלי ישנם תמציות הומאופתיות נפוצות לטיפול באורטיקריה והם:
Rhus Toxicodendron – היא תרופה נפוצה לטיפול באורטיקריה, מכינים אותה מהצמח אוג ארסי (Poison ivy) העלים וקליפת הצמח מכילים חומר רעיל הגורם לתגובה אלרגית. תרופה זאת יעילה בעיקר לאורטיקריה שנובעת משיפה למים ולקור.
Urtica Urens – עשויה מצמח הנקרא סרפד צורב (stinging nettle) לסרפדים יש שערות דוקרניות קטנות שנדבקות בעורכם יוצרות גירוד כמו האורטיקריה כמעט באופן מיידי.
התרופה הזאת נחשבת מאוד טובה לאורטקריה עונתית שחוזרת כל שנה או עקב אכילת מאכלי ים.
Apis mellifica – תרופה זאת מוכנת מדבורת הדבש. מיועדת בעיקר לסובלים מאורטיקריה בעקבות חום. ממליצים להשתמש בתמצית זאת ולצאת לאויר הפתוח.
Natrum Muriaticum – תרופה זאת מכינים מנתרן כלורי (מלח), לרוב יתנו תרופה זאת לסובלים מאוריטקריה כרונית המופיעה אחרי מאמץ גופני.
Carcinosin – זוהי תרופה (15) שמכינים אותה מסוג של רקמות סרטן השד (carcinoma) בהומאפתיה סוגי אלה של תרופות נחשבות כמו חיסון אך זה לא באמת החיסון המערבי שאנחנו מכירים. זה נקרא Nosodes התרופה בפועל אינה מכילה חלק מהחומר המקורי בצורה החומרית שלו.
הרפואה ההומאפתית אמינה שסיבה נוספת למחלה מקורה בגנטיקה של הבנאדם ומטרתה של תרופה זאת היא להילחם בתופעה הגנטית.
Medusa – זוהי תרופה שמכינים ממדוזות, זו אחת התרופות ההומאופתיות הספציפיות לאורטיקריה.
Astacus Fluviatilis – תרופה זאת מוכנת מסרטן (החיה) – היא ניתנת לאנשים שסובלים מאוד מהגירוד בכל הגוף עקב אורטיקריה
אורטיקריה רפואה סינית
הטיפול באורטיקריה ברפואה הסינית יכלול דיקור סיני, תזונה ואיזון הנפש והגוף
אורטיקריה ידועה ברפואה הסינית בשם תיקון פריחות הרוח Feng Zhen Kuai
הכוונה מאחורי השם היא של נגעים שבאים והולכים וחוזרים כמו הרוח.
הסיבות לאורטיקריה לפי הרפואה הסינית:
מחסור/יובש ביין – אם הגוף יבש מדי, כאשר נכנסים אלרגנים כלשהם, אין מספיק לחות בגוף כדי לשטוף אותם מהמערכת. זה גורם להתפרצות האורטיקריה
הצטברות חום בקיבה וכליות: עודף החום מעמיס על הגוף וגורם להתפרצות הנגעים על העור.
מתח – כאשר אדם נמצא במתח זמן רב יורדת כמות ה הצ'י בגוף מה שמוריד את תפקוד הכבד והכליות שאמורים לסנן רעלים. עקב זה הגוף מנסה להיפטר מהרעלים דרך העור.
ברפואה המערבית, כאשר לאדם יש אורטיקריה בעקבות חשיפה למאכלים מסוימים כמו אוכל חריף ואלכוהול היא נחשבת כתגובה אלרגית, אך ברפואה הסינית רואים זאת כתגובת הגוף לחום רב מדי.
טיפול ברפואה הסינית:
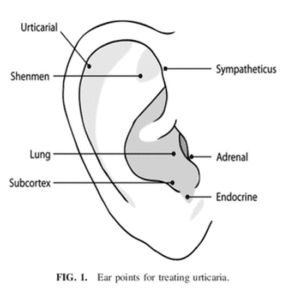
- דיקור סיני – מחקרים מראים יעילות מסוימת (יכול להיות פלסבו ואולי לא). מטרתו של הדיקור הסיני הוא הורדת הגרד והחזרת האיזון לגוף. הטיפול נחשב כבטוח ויכול להיות יעיל (17)
- הימנעות ממקלחות חמות ממושכות
- השתדל לנוח ולישון הרבה
- הימנעות ממזון חם, חריף ומאלכוהול
- שימוש בצמחי מרפא סינים
נקודות לחיצה נפוצות לדיקור סיני לטיפול באורטיקריה
אורטיקריה באיורוודה
איורוואדה (Ayurveda) היא שיטת טיפול הודית עתיקה, המשמעות שלה היא ידע החיים הארוכים
באירוודאה מתאימים טיפול לפי הסוג הספציפי של האדם. הטיפול כולל צמחי מרפא, פורמולות , שינוי אורח חיים ותזונה.
באירוואדה אורטיקריה נקראת Sheetapitta, Sheeta-pitta מכיל שתי מילים שבהן sheeta פירושו קר ו- pitta פירושו חם.
הסיבות לאורטיקריה (Sheetapitta) באיורוודה:
- צריכה עודפת של מזונות מלוחים, חריפים ומזון מעובד.
- צריכה מוגזמת של חרדל
- חשיפה לרוח קרה
- מגע ממושך עם חומרים קרים
- שינה מוגזמת במשך היום
- עקיצות חרקים
- מגע של חומרים רעילים
- מתח
- מעבר עונות
טיפולים לפי האירוואדה:
- הימנע כמה שאפשר מאכילת מוצרים מלוחים וחמוצים (כמו יוגורט)
- בצל ושום נחשבים טובים במקרה של אורטיקריה
- יש לנהל יומן מזון בשביל לאתר את הקשר בין מאכלים מסוימים להופעת הפריחה
- הימנע מסוכר ומאכלים מתוקים
- הימנע ממאכלים חריפים ואלכוהול
- הימנע ממאכלים שקשים לעיכול
- אפשר לצום ליום אחד
- לאכול מאכלים קלים כמו אורז מבושל ומרק ירקות
- תרופות מומלצות: Arogyavardhini , Haridrakhandam , patolakaturohinyadi , kashayam
- צמחי מרפא: כורכום, nimba, amrita, Neem, Ashwagandha, katuki herb , Nishotah
- למרוח משחת צמח נים או אלוורה
- כפית אבקת כורכום 2-3 פעמים ביום להגברת המערכת החיסונית
- לעשות עיסוי לעור עם שמן חרדל ואז מקלחת מים פושרים
יוגה ומדיטציה:
מומלץ לתרגל יוגה ומדיטציה להפחתת מתחים וטיפול כללי.
סוגי היוגה המומלצים לאורטיקריה (22)
- Brashrika Pranayama
- Surya Namaskar
- Halasana
- Matsyasana
- Trikonasana
- Bhujangasana
נטורופתיה לטיפול באורטיקריה
פירוש השם נטורופתיה היא מחלה טבעית והיא מתמקדת בניקוי רעלים ותמיכה של תוספי תזונה ותרופות טבעיות בשביל "לעזור" לגוף להירפא מעצמו.
טיפול נטורופתי לאורטיקריה:
- תוספים פרוביוטיים – חיידקים טובים לגוף
- חומצות שומן אומגה 3 בצורה של זמן דגים הוא בעל תכונות אנטי דלקתיות
- קוורצטין פלבנואיד – קוורצטין פועל כאנטי-היסטמין טבעי
- טירוזין – עוזר להפגת מתחים
- דיאטה דלת היסטמין – הימנעות ממאכלים ריבויי היסטמין כמו:
- מוצרי חלב מותססים כמו יוגורט, שמנת חמוצה וכו
- ירקות מותססים כמו מלפפון חמוץ, כרוב כבוש
- בשר מעובד כמו נקניקיות
- יין, בירה, אלכוהול ושמפניה
- רוטב סויה
- עגבניות
- חציל
- תרד
- דגים משומרים – כמו טונה וסרדינים
- חומץ
- קטשופ
- הימנעות מחומרי טעם וריח מלכותיים
- שימוש בתוספי אנט היסטמין טיבעיים
- תוספים להחזרת החמציות לקיבה
- Meyer’s Cocktail
- ויטמין c – יכול לעזור להוריד את רמת ההיסטמינים
- ויטמין ניאצינאמיד – לרוב מומלץ לקחת בשילוב עם טירוזין
- ביופלבנואידים – מעכב ייצור ושחרור של היסטמין
- ויטמין B12
אורטיקריה תרופות סבתא
"תרופות סבתא" או יותר נכון להגיד פתרונות זמינים ביתיים יכולים מאוד לעזור לאורטיקריה:
קומפרסור קר – פשוט הצמידו לעור לאזור המגורה משהו קר (אפילו שקית קפואה של מהפירזר של כל מאכל) למשך 10 דק כל פעם.
בגדים רחבים – לבשו בגדים לא צמודים לעור אלה משוחררים ואוורירים
גירוד – הימנעו מגירוד המקום או שימוש בסבון קשה
רישום – בצעו רישום כל פעם מתי הופיעו הנגעים בעור – מה אכלתם, איפה הייתם וכו.. יומן מעקב כזה יכול לעזור לכם להימנע בעתיד מטריגרים.
קרם הגנה – מרחו קרם הגנה לפני היציאה לשמש
אוכל – הימנעו ממאכלים יוצרי היסטמינים כמו" דגים,עגבניות, חלב, שוקולד, יוגורט, תותים ושוקולד.
אלכוהול – הימנעו מצריכת אלכוהול
מתח – תנסו למצוא דרכים להירגע כמו מדיטציה.
אורטיקריה ביטוח לאומי
שאלה שעולה הרבה היא האם ניתן לקבל עזרה כספית מביטוח לאומי עקב אורטיקריה כרונית.
ככלל אלרגיה אכן רשומה כאופציה לנכות בביטוח לאומי.
על מנת לקבל קצבה צריכים 2 תנאים:
- אחוזי נכות – צריך להיות 60% נכות רפואית או 40% כאשר לפחות אחד מהבעיות הוא בשיעור של 25%.
- הוכחה לפגישה בכושר ההשתכרות עקב המחלה.
אורטיקריה קהילות ותמיכה
יום המודעות לאורטיקריה מתרחש כל שנה ב1 לאוקטובר ונקרא יום האורטיקריה. (UDAY)
מקורות תמיכה ושיתוף ברשת:
בעברית:
באנגלית:
שאלות ותשובות נפוצות
האם ניתן לטפל באורטיקריה בטיפול טיבעי
הרבה אנשים פונים לטיפול טיבעי באורטיקריה כמו טיפול סיני או נטורופתיה.ישנם הרבה פעולות שניתן לעשות בבית בצורה טבעית שעליהם הרחבנו בכתבה באתר.לרוב כל המטפלים הטבעיים יטפלו בתזונה ובאנטי היסטמינים טבעיים רופאים סינים יבצעו גם דיקור להקלה בגירודים.
מתי לפנות לטיפול רפואי דחוף
יש לפנות לטיפול דחוף כאשר יש מרגישים שיש בעיה לנשום ואזור הצוואר מתנפח
אורטיקריה מה זה
אורטיקריה מופיעה כנגעים אדומים ומגרדים בעור. זוהי בעצם תגובה לא פרופורציונלית של מערכת החיסון בגוף שמפריש חומרים כאשר העיקרי בהם הוא היסטמין שגורם לפריחה ולגירוד.
כמה זמן יכולה אורטיקריה להימשך
זה תלוי בסוג האורטיקריה.
אורטיקריה חריפה – נמשכת פחות מ6 שבועות
אורטיקריה כרונית – נמשכת מעל ל6 שבועות ויכולה להגיע לכמה חודשים עד שנים לרוב היא תעלם יום בהיר אחד כמו שהגיע
האם אורטיקריה מדבקת
אורטיקריה אינה מדבקת וגם לרוב אינה מסכנת חיים
מה גורם לאורטיקריה
את הסיבות לאורטיקריה ניתן לחלק ל-2:
אלרגי ולא אלרגי.
אלרגי כולל: אוכל,תרופות,עקיצות חרקים,חיות ועוד..
לא אלרגי כולל: כימקלים, חשיפה לקור או חום, מחלות אוטואימוניות.
איך להיפתר מאורטיקריה
לרוב מה שעוזר הכי מהר הם כדורים אנטי היסטמינים או טיפול טיבעי של אנטי היסטמינים.
עבור הגירודים אפשר להצמיד קרח לאזור או להשתמש במשחות נגד גירודים
האם מתח גורם לאורטיקריה
לא בדיוק, למרות שמצאו קשר בין לחת נפשי ומתח להתפרצות הפריחה לרוטב זה אינו הגורם העיקרי. מה שכן מתח ולחץ אכן יגרום להחמרה של הפריחה.
אורטיקריה בלילה
אם אתם סובלים מאורטיקריה בלילה כנראה שאתם נחשפים לטריגר לפני השינה:
זה יכול להיות תרופה קבוע שאתם לוקחים, הבד שממנו עשויים הסדינים, ארוחת ערב ממרכבים דומים שאתם אוכלים כל ערב וכדומה.
מאמר מערכת ומקורות
- https://www.seattlechildrens.org/conditions/a-z/hives/
- https://medicaljournals.se/forum/articles/6/2/9-12.pdf
- https://www.aafp.org/pubs/afp/issues/2017/0601/p717-s1.html
- https://www.aad.org/public/diseases/a-z/hives-overview
- https://acaai.org/allergies/types-allergies/hives-urticaria
- https://www.biusante.parisdescartes.fr/sfhd/ecrits/the-history-of-urticaria-and-angioedema/
- https://www.aafp.org/afp/2017/0601/p717-s1.html
- https://www.aad.org/public/diseases/a-z/hives-overview
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4701915/
- https://www.aad.org/public/diseases/a-z/hives-treatment
- http://www.annallergy.org/article/S1081-1206(14)00012-X/abstract
- https://onlinelibrary.wiley.com/doi/full/10.1111/jdv.13198
- https://www.aad.org/public/diseases/a-z/hives-causes
- https://www.mayoclinic.org/diseases-conditions/rosacea/symptoms-causes/syc-20353815
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3242179/
- https://nccih.nih.gov/health/homeopathy
- https://pubmed.ncbi.nlm.nih.gov/16296917/
- https://www.hindawi.com/journals/bmri/2016/5191729/
- https://www.iafaforallergy.com/allergies-a-to-z/urticaria/